LEYES DE LOS GASES
LEY DE BOYLE MARRIOTE
“Cuando la temperatura permanece constante los volúmenes de los gases son inversamente proporcionales a las presiones”, es decir si la presión aumenta, el volumen disminuye.
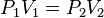

LEY DE CHARLES I
“Cuando la presión se mantiene constante, los volúmenes de los gases son directamente proporcionales a las temperaturas ABSOLUTAS”, es decir, que si la temperatura aumenta, el volumen también aumenta. Esta ley se fundamenta en que todo cuerpo por acción del calor se dilata.

LEY DE CHARLES II
Como principio fundamental se tiene que una molécula de cualquier gas que se encuentre a cero grados centígrados y una atmósfera de presión ocupa el volumen de 22,4 litros al cual se lo llama “volumen molar”. Es necesario recordar que las masas moleculares de las moles de los diferentes gases son diferentes pero el volumen es igual para todos ellos
LEY DE GAY LUSSAC
“Cuando el volumen se mantiene constante, las presiones que ejercen los gases son directamente proporcionales a sus temperaturas ABSOLUTAS”, de manera que si la temperatura aumenta, la presión también aumenta.

LEY COMBINADA
Tomando en cuenta la intervención simultánea de los tres factores físicos: presión, volumen y temperatura, es decir, combinando las tres leyes estudiadas Boyle, Charles y Gay Lussac, se tiene la ley combinada.

ECUACIÓN GENERAL
La constante universal de los gases se calcula tomando en cuenta las condiciones normales de un gas, esto es: una mol, 1 atm, 22,4 litros y 273 K. Por lo tanto si en la fórmula general despejamos R, tendremos:
R = P x V = 1 atm x 22,4 litros = 0.082 at – li
N x T 1 mol x 273 K mol - K

LEY DE DALTON
“La presión total de una mezcla de dos o más gases que no reaccionan entre sí es igual a la suma de las presiones de los componentes”

EJERCICIOS SOBRE LAS LEYES DE LOS GASES
Ejercicio Nº 1
A presión de 17 atm, 34 L de un gas a temperatura constante experimenta un cambio ocupando un volumen de 15 L ¿Cuál será la presión que ejerce?
Solución:
Primero analicemos los datos:
Tenemos presión (P1) = 17 atm
Tenemos volumen (V1) = 34 L
Tenemos volumen (V2) = 15 L
Claramente estamos relacionando presión (P) con volumen (V) a temperatura constante, por lo tanto sabemos que debemos aplicar la Ley de Boyle y su ecuación (presión y volumen son inversamente proporcionales):
Reemplazamos con los valores conocidos
Colocamos a la izquierda de la ecuación el miembro que tiene la incógnita (P2) y luego la despejamos:
Respuesta:
Para que el volumen baje hasta los 15 L, la nueva presión será de 38,53 atmósferas.
Ejercicio Nº 2
A presión constante un gas ocupa 1.500 (ml) a 35º C ¿Qué temperatura es necesaria para que este gas se expanda hasta alcanzar los 2,6 L?
Solución:
Analicemos los datos:
Tenemos volumen (V1) = 1.500 ml
Tenemos temperatura (T1) = 35º C
Tenemos volumen (V2) = 2,6 L
Lo primero que debemos hacer es uniformar las unidades de medida.
Recuerda que el volumen (V) debe estar en litros (L) y la temperatura (T) en grados Kelvin.
V1 = 1.500 mililitros (ml), lo dividimos por 1.000 para convertirlo en 1,5 L
T1 = 35º C le sumamos 273 para dejarlos en 308º Kelvin (recuerda que 0º C es igual a 273º K) (Nota: En realidad son 273,15, pero para facilitar los cálculos prescindiremos de los decimales).
V2 = 2,6 L, lo dejamos igual.
En este problema estamos relacionando volumen (V) con temperatura (T), a presión constante, por lo tanto aplicamos la fórmula que nos brinda la Ley de Charles (volumen y temperatura son directamente proporcionales).
Reemplazamos con los valores conocidos
Desarrollamos la ecuación:
Primero multiplicamos en forma cruzada, dejando a la izquierda el miembro con la incógnita, para luego despejar T2:
Entonces, para que 1,5 L expandan su volumen hasta 2,6 L hay que subir la temperatura hasta 533,78º Kevin, los cuales podemos convertir en grados Celsius haciendo la resta 533,87 − 273 = 260,87 º C.
Respuesta:
Debemos subir la temperatura hasta los 260,87º C.
Ejercicio Nº 3
A volumen constante un gas ejerce una presión de 880 mmHg a 20º C ¿Qué temperatura habrá si la presión aumenta en 15 %?
Analicemos los datos:
Tenemos presión P1 = 880 mmHg
Tenemos presión P2 = 880 mmHg más el 15 % = 880 +132= 1.012 mmHg
Tenemos temperatura T1 = 20º C
Lo primero que debemos hacer es uniformar las unidades de medida.
Recuerda que la temperatura (T) debe estar en grados Kelvin, y que la presión (P) puede estar solo en atm o solo en mmHg en una misma ecuación.
P1 = 880 mmHg, lo dejamos igual
P2 = 1.012 mmHg lo dejamos igual
T1 = 20º C le sumamos 273 para dejarlos en 293º Kelvin (recuerda que 0º C es igual a 273º K) (Nota: En realidad son 273,15, pero para facilitar los cálculos prescindiremos de los decimales).
En este problema estamos relacionando presión (P) con temperatura (T) a volumen (V) constante, por lo tanto aplicamos la fórmula que nos brinda la Ley de Gay-Lussac (presión y temperatura son directamente proporcionales).
Reemplazamos con los valores conocidos
Desarrollamos la ecuación:
Primero multiplicamos en forma cruzada, dejando a la izquierda el miembro con la incógnita, para luego despejar P2:
Respuesta:
Si aumentamos la presión en 15 % el gas quedará a una temperatura de 336,95º K, los cuales equivalen a 63,95º C. (336,95 − 273 = 63,95º C).
No hay comentarios.:
Publicar un comentario