ÁTOMO Y MOLÉCULA
EL ÁTOMO
El átomo es la mínima unidad de materia que puede existir, representando las características de un elemento. Se representa por medio de símbolos: es la letra o letras que se emplean para representarlos. Ejemplos: Al (aluminio), P (fósforo), He (helio).
el átomo está formado por :
Protones (carga +)
Fue descubierto por Ernest Rutherford a principios del siglo XX. Se encuentra en el núcleo. Tiene carga eléctrica positiva.
Neutrones (carga neutra)
Constituyen los núcleos de los átomos junto a los protones . Fueron descubiertos en 1930 por dos físicos alemanes, Walter Bothe y Herbert Becker. No tiene carga eléctrica ya que son neutros (igual cantidad de protones y electrones) por lo que tiene su carga 0.
Electrones (carga -)
Se están moviendo constantemente alrededor del núcleo siguiendo unas órbitas. Fue descubierto por Joseph Thomson en 1897. Es una partícula subatómica. Tiene carga eléctrica negativa.
MOLÉCULA
Una molécula es un conjunto de átomos, iguales o diferentes, que se encuentran unidos mediante enlaces químicos.
El caso que los átomos sean idénticos se da por ejemplo en el oxígeno (O2) que cuenta con dos átomos de este elemento; o pueden ser diferentes, como ocurre con la molécula del agua, la cual tiene dos átomos de hidrógeno y uno solo de oxígeno (H2O).
También se puede definir como la mínima unidad que puede existir representando las características de compuestos y son representados en fórmulas que son la estructura fundamental de un compuesto.
EJEMPLO: P2O5 (Pentóxido de di fósforo o Anhídrido fosfórico), BaCl2 (Cloruro de Bario), FeS (sulfuro de hierro II o Sulfuro ferroso), etc.
-sulfide-unit-cell-3D-balls.png)
ION: CATIÓN Y ANIÓN
Se define al ion como un átomo o una molécula cargados eléctricamente, debido a que ha ganado o perdido electrones de su dotación normal, lo que se conoce como ionización.
Los iones cargados negativamente, producidos por la ganancia de electrones, se conocen como aniones y los cargados positivamente, consecuencia de una pérdida de electrones, se conocen como cationes.
Un catión es un ion (sea átomo o molécula) con carga eléctrica positiva, esto es, con defecto de electrones. Los cationes se describen con un estado de oxidación positivo.
Un anión es un ion (sea átomo o molécula) con carga eléctrica negativa, esto es, con exceso de electrones. Los aniones se describen con un estado de oxidación negativo.
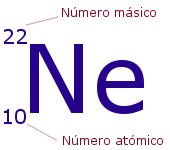
NÚMERO ATÓMICO
Los átomos de diferentes elementos presentan distintas cantidades de protones. El número atómico (que se identifica con la letra Z, por el término alemán zahl) indica la cantidad de protones que se encuentra presente en el núcleo de un átomo. Este número, por lo tanto, se encarga de definir la configuración electrónica del átomo y permite el ordenamiento de los diversos elementos químicos en la tabla periódica, que comienza con el hidrógeno (Z=1) y sigue con el helio, el litio, el berilio, el boro, el carbono y el nitrógeno.
Asimismo tenemos que añadir que ese número de protones que existe en el núcleo de un átomo en concreto es igual al número de electrones que lo rodea en lo que se da en llamar corteza.
La lista de elementos químicos establecida en base al número atómico de los mismos podemos determinar que está encabezada por estos diez elementos: con el 1 el hidrógeno, con el número 2 el helio, el 3 es para el litio, el 4 es el berilio, el 5 lo ocupa el boro, el 6 es el carbono, el 7 el nitrógeno, el 8 el oxígeno, el 9 el flúor y el 10 el neón.
A ello podemos añadir también que en total dicho listado está formado por un total de 115 elementos químicos, siendo el último de ellos el ununoctio. Presuntamente este es un gas noble incoloro que tiene como símbolo temporal el siguiente: Uuo.
MASA ATÓMICO O NÚMERO MÁSICO
Se conoce como masa atómica a la masa que posee un átomo mientras éste permanece en reposo. En otras palabras, puede decirse que la masa atómica es aquella que surge de la totalidad de masa de los protones y neutrones pertenecientes a un único átomo en estado de reposo. Dentro del Sistema Internacional, la unidad que permite calcularla y reflejarla es la masa atómica unificada.
Cabe resaltar que las masas atómicas también suelen ser definidas como peso atómico. Sin embargo, esto no es del todo acertado debido a que la masa constituye una propiedad del cuerpo y el peso varía de acuerdo a la gravedad.
En esta materia tenemos que hacer referencia a los orígenes de la misma en la ciencia. Más concretamente a los científicos que apostaron por la citada, por calcular y por trabajar con ella con el claro objetivo de llevar a cabo una serie incuestionable de estudios y de beneficios en pro del avance.
Así, podemos subrayar que entre los primeros personajes que hablaron de peso atómico y que calcularon el mismo se encuentra el químico inglés John Dalton. Este es conocido, y ha pasado a la historia, por haber desarrollado una teoría en este sentido que se sustentaba en cinco puntos fundamentales.
En concreto, los pilares de su pensamiento eran los siguientes: los elementos están conformados por átomos, los átomos pertenecientes a un único elemento son todos iguales o dichos átomos son diferentes a los que posee cualquier otro elemento y se distinguen por su peso atómico.
A estas dos observaciones claras, añadió otras dos más: la unión de átomos de diferentes elementos dan lugar a compuestos químicos y dichos átomos no se pueden crear, ni destruir ni dividir en lo que es el proceso químico.
Además de John Dalton tampoco podemos pasar por alto la figura de otro científico importante en materia de masa atómica. Nos estamos refiriendo a Jöns Jakob Berzelius, un químico sueco que, junto al anterior científico y algunos más, está considerado como el padre de la química moderna. Polímero, catálisis o isómero fueron algunos de los conceptos que este acuñó y que introdujo en dicha ciencia.
Sobre la masa atómica de los elementos de tipo químico hay que decir que se pueden calcular a partir de la media ponderada de las masas de los diversos isótopos pertenecientes a cada elemento, contemplando la abundancia relativa de los mismos. Esto ayuda a explicar la falta de correspondencia entre la masa atómica en umas (unidad de masa atómica) de una sustancia y el número de nucleones que contiene el núcleo de su isótopo más común.
No obstante, dicen los expertos que la masa atómica de un isótopo siempre coincide, de modo aproximado, con la masa de sus nucleones. La diferencia se produce porque los elementos no están compuestos por un único isótopo, sino por una combinación donde están presentes unas abundancias para cada uno de los elementos, mientras que cuando se mide la masa de un isótopo en concreto no se contemplan las abundancias.
De todas maneras, debido al defecto de masa (que resulta del cálculo de la diferencia entre dos factores: la masa medida de modo experimental y la reflejada por su número másico A), la masa atómica de los isótopos no es equivalente a la suma total de las masas de los llamados nucleones.
No hay comentarios.:
Publicar un comentario