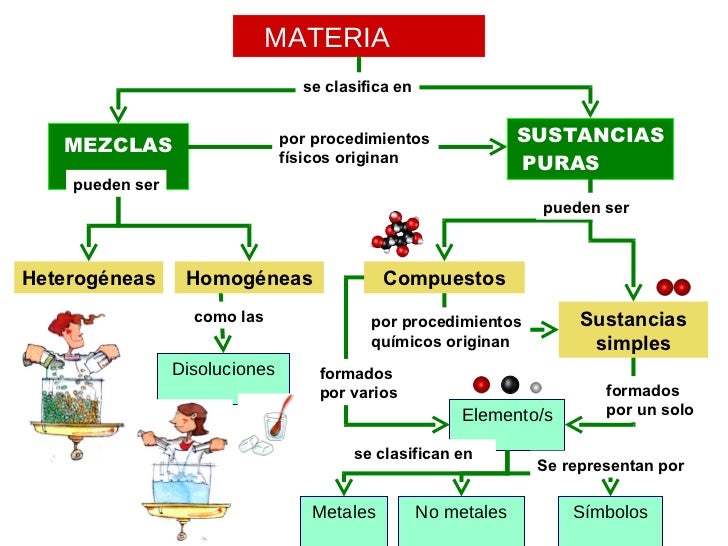
MATERIA
Materia es todo aquello que posee masa y ocupa un lugar en el espacio. Los cambios que la materia sufre involucra ganancia o pérdida de energía.
ENERGÍA
Energía es la capacidad para hacer un trabajo
CUERPO
Es la porción limitada de la materia con forma determinada
CLASIFICACIÓN DE LA MATERIA
Una sustancia pura es aquella que tiene unas propiedades específicas que la caracterizan y que sirven para diferenciarla de otras sustancias. Las sustancias puras pueden ser sustancias simples (elementos) o compuestos. Tienen las siguientes características:
•Presenta una composición fija, no puede
separarse por medios físicos y su temperatura permanece constante durante el
cambio de estado. Se clasifican en
sustancia pura simple y sustancia pura compuesta
•Elemento, son sustancias simples que no se
descomponen por medios químicos. Ej. Au
(Oro)
•Compuesto, son sustancias
que están formadas por dos o más elementos y pueden descomponerse por medios
químicos. Ej. NaCl (Sal).

MEZCLAS

Cristalización y precipitación: esta permite la separación de un soluto sólido de que se encuentra disuelto en un disolvente. Se calienta la disolución para concentrarla, luego se la filtra y se la coloca en un cristalizador hasta que se evapore el líquido, quedando el sólido en forma de cristal.
EJERCICIO EN CLASE:
CLASIFICA ENTRE SUSTANCIA PURA, MEZCLA HOMOGÉNEA Y MEZCLA HETEROGÉNEA
1.AIRE (Mezcla homogénea)
2.PERFUME Mezcla homogénea)
3.OXÍGENO EN UN TANQUE DE OXÍGENO DE UN HOSPITAL (Sustancia Pura Compuesta)
4.YODO (Sustancia Pura Simple)
5.AZÚCAR (sustancia pura compuesta)
6.TIERRA Y AGUA (mezcla homogénea/heterogénea)
7.CAFÉ CON LECHE (mezcla homogénea)
8.PAPEL Y ASERRÍN (mezcla heterogénea)
9.CLORO (sustancia pura simple)
10.PIEDRAS Y ARENA (mezcla heterogénea)
- Mezclas homogéneas : Aquellas mezclas que sus componentes no se pueden diferenciar a simple vista. Las mezclas homogéneas de líquidos se conocen con el nombre de disoluciones y están constituidas por un soluto y un disolvente, siendo el primero el que se encuentra en menor proporción y además suele ser el líquido. Por ejemplo, el agua mezclada con sales minerales o con azúcar, el agua es el disolvente y el azúcar el soluto.
- Mezclas Heterogéneas : Aquellas mezclas en las que sus componentes se pueden diferenciar a simple vista.

Las técnicas que se utilizan para separar las mezclas son:
Tamización: esta puede ser utilizada para la separación de mezclas sólidas, compuestas con granos de diversos tamaños. Lo que se hace es hacer pasar a la mezcla por varios tamices (tabla con agujeros de pequeño tamaño).
Filtración: esta técnica permite la separación de aquellas mezclas que están compuestas por líquidos y sólidos no solubles, es decir que los sólidos no se disuelven en el líquido. Por ejemplo el azucar se disuelve con el agua, pero si echamos arena esta no se disuelve, es decir no es soluble. Para separar estas mezclas, se utiliza un embudo con un papel de filtro en su interior. Lo que se hace pasar a la mezcla por ellos.
Separación magnética: esta técnica sólo es útil a la hora de separar sustancias con propiedades magnéticas de aquellas que no las poseen. Para esto, se utilizan imanes que atraen a las sustancias magnéticas y así se logra separarlas de las que no lo son.
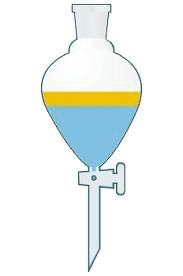
Decantación: Decantar es dejar reposar la mezcla. Esta técnica sirve para la separación de líquidos que tienen diferentes densidades y no son solubles entre sí. En esta técnica se requiere un embudo de decantación que contiene una llave para la regulación del líquido. Una vez decantada la mezcla (dejar en reposo) el elemento más denso irá al fondo y por medio del embudo de decantación, cuando se abre la llave se permite el paso del líquido más denso hacia un recipiente ubicado en la base, quedando el líquido con menor densidad en la parte de arriba del embudo.

Cristalización y precipitación: esta permite la separación de un soluto sólido de que se encuentra disuelto en un disolvente. Se calienta la disolución para concentrarla, luego se la filtra y se la coloca en un cristalizador hasta que se evapore el líquido, quedando el sólido en forma de cristal.
Destilación: es útil para la separación de líquidos que son solubles entre sí. Lo que se hace es hervirlos y, como esto lo hacen a distintas temperaturas de ebullición, se toman sus vapores por un tubo para luego pasarlo al estado líquido nuevamente. Esto es posible gracias a que hierven en distintos tiempos. Por ejemplo imaginemos agua y sal. El agua hierve a 100ºC, si calentamos la mezcla a esa temperatura lo que se evapora será el agua, la sal no se evaporará (tiene temperatura de ebullición más alta). Si recogemos el vapor tenemos el agua separada de la sal.
Por último tenemos la Cromatografía
EJERCICIO EN CLASE:
CLASIFICA ENTRE SUSTANCIA PURA, MEZCLA HOMOGÉNEA Y MEZCLA HETEROGÉNEA
1.AIRE (Mezcla homogénea)
2.PERFUME Mezcla homogénea)
3.OXÍGENO EN UN TANQUE DE OXÍGENO DE UN HOSPITAL (Sustancia Pura Compuesta)
4.YODO (Sustancia Pura Simple)
5.AZÚCAR (sustancia pura compuesta)
6.TIERRA Y AGUA (mezcla homogénea/heterogénea)
7.CAFÉ CON LECHE (mezcla homogénea)
8.PAPEL Y ASERRÍN (mezcla heterogénea)
9.CLORO (sustancia pura simple)
10.PIEDRAS Y ARENA (mezcla heterogénea)
SISTEMA MATERIAL
Un sistema material es una porción de la materia, confinada en una porción de espacio, y que se ha seleccionado para su estudio. Se diferencia de un objeto físico en que éste tiene unos límites bien definidos, mientras los sistemas materiales no presentan límites tan precisos.
Clasificación de los sistemas materiales:
Pueden ser:
Homogéneos: Presentan la misma composición química e iguales propiedades en todos sus puntos. Presentan una sola fase que puede estar en estado sólido, líquido o gaseoso.
Heterogéneos: No son uniformes, presentan una estructura y una composición diferente en distintos puntos. Ésto provoca que tengan dos o más fases.

PROPIEDADES DE LA MATERIA
Cada material o sustancia tiene un conjunto de propiedades, características que le dan su única identidad. Las propiedades de las sustancias se clasifican como organolépticas, físicas y químicas
PROPIEDADES ORGANOLÉPTICAS
•Color: Se puede distinguir por: Transparencia, la luz atraviesa la sustancia y llega así a nuestros ojos. Reflexión, la luz incide lateralmente y recién entonces nos impresiona.
•Ejemplo: Cuando vemos a través de vidrio vemos por transparencia.
Cuando vemos la superficie de un mueble lo vemos por reflexión
•Olor: Impresiona por el sentido del olfato. Aquellas sustancias que no nos impresionan por el sentido, son inodoras
•Sabor: Nos impresiona por el sentido del gusto. Los sabores pueden ser: dulce, salado, amargo, agrio. Las sustancias que carecen de sabor se llaman insípidas
•Impresión al tacto: Rugoso, áspero, liso, untuoso, etc.
•Sonido: Puede ser grave o agudo. En general las sustancias cristalizadas producen sonido armónico mientras que las amorfas producen ruido.
PROPIEDADES INTENSIVAS Y EXTENSIVAS
Propiedades Intensivas: No dependen de la cantidad de la materia, color, dureza, densidad, punto de fusión, etc.
Propiedades Extensivas: Dependen de la cantidad de materia, volumen, peso, longitud, etc.
PROPIEDADES FÍSICAS
Son aquellas que se pueden determinar sin alterar la identidad de la sustancia. Pueden ser generales o particulares.
•Inercia: Es la propiedad por la que todos los cuerpos tienden a mantenerse en su estado de reposo o movimiento.
•Impenetrabilidad: Es la imposibilidad de que dos cuerpos distintos ocupen el mismo espacio simultáneamente. Es la resistencia que pone un cuerpo a ser traspasado. Ejemplo: En un recipiente de 20 lt solo se puede colocar 20 lt de líquido, si se quiere colocar más este no cabe.
•Discontinuidad: Se refiere a que la materia está formada por partículas, antes se pensaba que la materia era continua, es decir, que podía dividirse infinitamente y cada pedazo conservaba sus propiedades. Pero al estar formada por partículas tiene un límite para la división por lo que se dice que la materia es discontinua.
•Elasticidad: Propiedad que tienen los cuerpos de cambiar su forma cuando se les aplica una fuerza adecuada y de recobrar la forma original cuando se suspende la acción de la fuerza.
•Indestructibilidad: Propiedad que tienen los cuerpos de ser indestructibles – Ley de Lavoisier. Ejemplo: El Tungsteno, El Oro
•Densidad: Cantidad de masa ejercida por un volumen dado de un material. Usualmente expresada en libras por pie cúbico (lb/ft3) o gramos por centímetro cúbico (g/cm3).En el caso de los gases, la densidad es afectada de manera importante por la temperatura y la presión. Cuando hablamos de sólidos y líquidos el punto de referencia es la densidad del agua. Cuando hablamos de la densidad de los gases el punto de referencia es la densidad del aire. Es la cantidad de masa por la unidad de volumen.
•Dureza: Propiedad de los sólidos, es la resistencia a la deformación. En mineralogía se utiliza la escala Mohs creada por el austriaco Friedrich Mohs, que mide la resistencia al rallado de los materiales.
•Divisibilidad: Es la propiedad que tiene cualquier cuerpo para poder dividirse en pedazos más pequeños, hasta llegar a las moléculas y átomos.
OTRAS PROPIEDADES EXTENSIVAS
Masa: Es la cantidad de materia contenida en un volumen cualquiera, la masa de un cuerpo es la misma en cualquier parte de la tierra.
Peso: Es la acción de la gravedad de la Tierra que ejerce sobre los cuerpos.
Volumen: Es una magnitud que se define como el espacio ocupado por un cuerpo.
Maleabilidad: Es la capacidad para convertirse en láminas, por ejemplo el estaño.
Ductilidad: Facilidad para transformarse en hilos
Viscosidad: Es la propiedad de los fluidos por la que presentan resistencia a la velocidad de deformación. Resistencia que opone un líquido a fluir como consecuencia de la atracción molecular (cohesión).

PROPIEDADES QUÍMICAS
Son aquellas que nos indican la tendencia de las sustancias para reaccionar y transformarse en otras como oxidarse, combustionar, inflamarse, estallar, enmohecerse. Sufren alteración en su estructura interna o molecular cuando actúan con otras sustancias. Ejemplo: El sodio reacciona violentamente con el agua fría para formar Hidróxido de sodio mientras que el Calcio reacciona muy lentamente con el agua para formar Hidróxido de Calcio
 |
| soda cáustica (hidróxido de sodio) |
CAMBIOS DE LA MATERIA
CAMBIOS FÍSICOS
Todos los días ocurren cambios en la materia que nos rodea. Algunos hacen cambiar el aspecto, la forma, el estado. A estos cambios los llamaremos cambios físicos de la materia.
Entre los cambios físicos más importantes tenemos los cambios de estado, que son aquellos que se producen por acción del calor.
CAMBIOS QUÍMICOS
Son aquellos cambios que alteran la composición química de la materia originando otras sustancias.
ESTADOS DE LA MATERIA
Estado sólido
Las fuerzas de cohesión de sus moléculas son mayores que las fuerzas de repulsión, sus cuerpos son compactos, presentan volumen y forma definida. Ejemplo: Hierro, aluminio, azúcar.
Estado líquido
Las fuerzas de cohesión son similares a las fuerzas de repulsión, presentan un volumen definido, su forma es variable (de acuerdo al recipiente que lo contenga). Ejemplo: Agua oxigenada.
Estado gaseoso
Las fuerzas de dispersión o expansión son mayores que las fuerzas de atracción o cohesión, por lo tanto no tienen volumen ni forma definida. Ejemplo: el aire, el oxígeno.
CAMBIOS DE ESTADO

Fusión:
Es el paso de un sólido al estado líquido por medio del calor. Proceso endotérmico. El punto de fusión es la temperatura a la cual el sólido se funde, por lo que su valor es particular para cada sustancia.
Solidificación:
Es el paso de líquido a sólido por medio del enfriamiento. Proceso Exotérmico. El punto de solidificación o de congelación es la temperatura a la cual el líquido se solidifica y permanece constante durante el cambio
Vaporización:
Es el cambio de estado líquido a gaseoso. Hay dos tipos de vaporización: la ebullición y la evaporación. Ebullición: cuando el cambio ocurre por aumento de temperatura en el interior del líquido. (el líquido hierve). Evaporación: se produce a cualquier temperatura, siendo más rápida cuanto más elevada esta.
Condensación
Es el paso de forma gaseosa a forma líquida. Es el proceso inverso a la vaporización. El proceso de condensación suele tener lugar cuando un gas es enfriado hasta su punto de rocío, sin embargo este punto también puede ser alcanzado variando la presión. El equipo industrial o de laboratorio necesario para realizar este proceso de manera artificial se llama condensador.
Sublimación
Es el cambio de estado de materia sólida al estado gaseoso sin pasar por el estado líquido.
Al proceso inverso se denomina sublimación inversa.


No hay comentarios.:
Publicar un comentario