EL ÁTOMO
Del latín atŏmum, un átomo es la cantidad menor de un elemento químico que tiene existencia propia y que está considerada como indivisible.
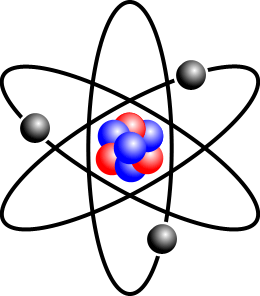
ESTRUCTURA DEL ÁTOMO
El átomo está formado por un núcleo con protones y neutrones y por varios electrones orbitales, cuyo número varía según el elemento químico. Los protones tienen una carga energética positiva, mientras que los neutrones no presentan carga. La diferencia entre los distintos elementos químicos está dada por la cantidad de protones y neutrones de sus átomos. Por otra parte, la cantidad de protones que contiene el núcleo de un átomo recibe el nombre de número atómico.
MODELOS ATÓMICOS
MODELO DE DALTON
El modelo atómico de Dalton fue expuesto en un libro llamado
“Nuevo sistema de filosofía química”, y en síntesis decía lo siguiente:
* La materia está formada por
partículas pequeñísimas llamadas “átomos”.
* Estos átomos no se pueden
dividir ni romper, no se crean ni se destruyen en ninguna reacción química, y
nunca cambian.
*Los átomos de un mismo elemento
son iguales entre sí, tienen la misma masa y dimensiones; por ejemplo, todos
los átomos de hidrógeno son iguales.
* Por otro lado, los átomos de
elementos diferentes, son diferentes; por ejemplo, los átomos de oxígeno son
diferentes a los átomos de hidrógeno.
* Los átomos pueden combinarse
para formar compuestos químicos. Por ejemplo, los átomos de hidrógeno y oxígeno
pueden combinarse y formar moléculas de agua.
* Los átomos, al combinarse para
formar compuestos guardan relaciones simples.
*Los átomos de elementos
diferentes se pueden combinar en proporciones distintas y formar más de un
compuesto. Por ejemplo, un átomo de carbono con uno de oxígeno forman monóxido
de carbono (CO), mientras que dos átomos de oxígeno con uno de carbono, forman
dióxido de carbono (CO2)
Algunas de estos planeamientos perdieron vigencia con el tiempo.
Hoy sabemos que los
átomos sí se pueden dividir y
que no todos los átomos de un mismo elemento son iguales; pero es innegable que
fueron muy importantes para la ciencia.
Esa no fue, sin embargo, la única contribución de John Dalton. Hizo muchos otros aportes en el campo de la meteorología y la física, e incluso en la medicina: cuando tenía 26 años se dio cuenta de que tanto él como su hermano confundían los colores. Realizó un detallado estudio de la enfermedad visual que padecía, el primero de su tipo, y por tanto desde ese momento se llamó “daltonismo”. En 1832 fue invitado a visitar al rey Guillermo IV y, cuál no fue la sorpresa de los presentes cuando el eminente científico llegó vistiendo un llamativo traje de color rojo. Claro, él lo veía gris oscuro, porque era, además de Dalton, daltónico.
Esa no fue, sin embargo, la única contribución de John Dalton. Hizo muchos otros aportes en el campo de la meteorología y la física, e incluso en la medicina: cuando tenía 26 años se dio cuenta de que tanto él como su hermano confundían los colores. Realizó un detallado estudio de la enfermedad visual que padecía, el primero de su tipo, y por tanto desde ese momento se llamó “daltonismo”. En 1832 fue invitado a visitar al rey Guillermo IV y, cuál no fue la sorpresa de los presentes cuando el eminente científico llegó vistiendo un llamativo traje de color rojo. Claro, él lo veía gris oscuro, porque era, además de Dalton, daltónico.
MODELO DE THOMPSON
Después de observar que los rayos catódicos se producían para diferentes gases y, tener en cuenta el orden de magnitud de la relación entre la masa y la carga de los corpúsculos o electrones, Thomson formuló la hipótesis de que dichos electrones procedían de dentro de los átomos de los electrodos, lo que indicaba que los átomos son divisibles.
Lo expresó así:
"Después de largas meditaciones acerca de los experimentos, me pareció que eran ineludibles las conclusiones siguientes: 1) Los átomos no son indivisibles; porque de ellos se pueden arrancar partículas cargadas de electricidad negativa, por la acción de fuerzas eléctricas, el choque de átomos que se mueven con rapidez, la luz ultravioleta o el calor. 2) Todas esas partículas son iguales en cuanto a la masa y llevan la misma carga de electricidad negativa, sea cual fuere la especie de átomos de que salgan, y son elementos constitutivos de todo átomo. 3) La masa de dichas partículas es menos de un millonésimo de la masa de átomo de hidrógeno"
Sobre la base de estas hipótesis, Thomson fue el primer científico que planteó, en 1904, un modelo de estructura del átomo. Al ser tan pequeña la masa de los electrones, supuso que prácticamente toda la masa del átomo acumulaba la carga positiva y ocupaba todo el volumen atómico. Creyó también que esa masa de carga positiva era fluida y los electrones podían penetrar o incrustarse en ella. Como tienen carga negativa imaginó que estaban adheridos a la masa principal (de carga positiva) y se distribuían en posiciones equidistantes y lo más alejadas posible entre sí.
El modelo de Thomson pudo explicar de forma cualitativa algunos hechos experimentales, entre ellos la electrización por frotamiento y la emisión de luz por los átomos. Aunque en este modelo los electrones ocupan posiciones fijas en el seno de la masa positiva, las acciones exteriores pueden desplazarlos de esas posiciones e, incluso arrancarlos. Así se explicaría la electrización por frotamiento. Por otro lado, al pasar cerca del átomo una carga eléctrica, esta actuará sobre el electrón desplazándolo de su posición de equilibrio. Una vez alejada la carga, el electrón recuperará la posición inicial describiendo un movimiento vibratorio responsable de la emisión de luz.
Como curiosidad diremos que el modelo atómico de Thomson se llamó modelo de "budín de pasas", estableciendo una analogía entre el pastel inglés y el átomo. La masa del budín representaría a la masa del átomo cargada positivamente y las pasas incrustadas en el pastel serían los electrones.
MODELO DE RUTHERFORD
Ernest Rutherford (1871-1937) físico y químico británico, de origen neozelandés, es considerado el padre de la física nuclear. A comienzos de 1911, propuso la idea de que el átomo de cualquier elemento se compone de un núcleo diminuto en el que se reúne toda la carga eléctrica positiva y casi toda la masa y de electrones con carga negativa que giran alrededor de este núcleo, como si fueran planetas de un pequeño sistema solar unidos por fuerzas eléctricas, en vez de por la fuerza de gravedad.
En los Laboratorios Cavendish de Cambridge, trabajaba también J. J. Thomson, el descubridor del electrón. Es difícil evitar el término “partículas” al hablar de entidades fundamentales como el electrón, pero hay que recordar que no se deben imaginar únicamente como pequeñas bolitas o concentraciones de masa y energía en un punto sólido. El electrón es una entidad fundamental que no está formada por cosas más pequeñas.
No se puede decir lo mismo del núcleo de un átomo. Al principio de la segunda década del siglo XX, Rutherford descubrió que el núcleo es como una bola formada partículas apretadas unas con otras, como en un racimo de uvas: los protones.
Resulta curioso observar que el término “núcleo”, no aparece en los escritos de Rutherford. Lo que él consideró esencial para explicar los resultados experimentales, fue "una concentración de carga" en el centro del átomo. Esta concentración de carga, que ahora todos denominan núcleo, era lo que podía explicar el hecho comprobado en sus experimentos de que algunas partículas salieran rebotadas en dirección casi opuesta a las partículas incidentes.
Este fue un paso crucial en la comprensión de la materia, ya implicaba la existencia de un núcleo atómico donde se concentraba toda la carga positiva y más del 99,9% de la masa. Las estimaciones del núcleo revelaban que el átomo en su mayor parte estaba vacío.
Lo que une los electrones al núcleo no es la fuerza de gravedad que es insignificante (leyes de Newton), sino la fuerza eléctrica (leyes de Maxwell). En general, un átomo tiene tantos electrones como protones tenga su núcleo.
El núcleo del uranio más común tiene 92 protones. Cada protón tiene una carga eléctrica positiva de igual magnitud que la carga eléctrica negativa del electrón.
De acuerdo al modelo atómico de Rutherford, el núcleo se compone de partículas con carga positiva, a las que denominó protones y de partículas con carga negativa, denominadas electrones. Las cargas eléctricas de protones y electrones son de distinto signo pero de igual intensidad. Por lo cual, los átomos son eléctricamente neutros.
En 1920, Rutherford predijo que en el núcleo de los átomos, existían otra partículas, a la que denominó neutrones, que tenían masa de similar magnitud a la de los protones, pero que no estaban dotadas de carga eléctrica.
El modelo atómico de Rutherford postulaba que los electrones orbitaban en un espacio vacío alrededor de una minúscula carga, situada en el centro del átomo. Esta teoría tropezó con varios problemas que, al intentar explicarlos, llevó al descubrimiento de nuevos hechos y teorías:
a) Por un lado se planteó el problema de cómo un conjunto de cargas positivas podían mantenerse unidas en un volumen tan pequeño, en vez de repelerse unas a otras, al tener cargas de igual signo. La solución a este problema llevó a pensar que en el interior del núcleo actuaba una fuerza desconocida hasta ese momento. Hoy la conocemos como fuerza nuclear fuerte, una de las cuatro interacciones fundamentales reconocidas en la teoría estándar de la materia.
b) Por otro lado, se decía que si los electrones son partículas con carga eléctrica, para mantenerse en órbita necesitan una aceleración, con lo cual producirían radiación electromagnética y eso les haría perder energía. Las leyes de Newton y las ecuaciones de Maxwell del electromagnetismo aplicadas al átomo de Rutherford llevan a que en un tiempo del orden de 10 − 10s, toda la energía del átomo se habría radiado, ocasionando la caída de los electrones sobre el núcleo.
El modelo atómico de Rutherford es un modelo físicamente inestable, desde el punto de vista de la física clásica. En el modelo de Rutherford, las órbitas de los electrones no están definidas y solamente se dice que forman una estructura compleja. No obstante, los resultados de su experimento, permitieron calcular que el radio del átomo era diez mil veces mayor que el núcleo mismo, de lo que se deducía que existe un gran espacio vacío en el interior de los átomos.

MODELO DE BOHR
En 1913 Bohr publicó una explicación teórica para el espectro atómico del hidrógeno. Basándose en las ideas previas de Max Plank, que en 1900 había elaborado una teoría sobre la discontinuidad de la energía (Teoría de los cuantos), Bohr supuso que el átomo solo puede tener ciertos niveles de energía definidos.
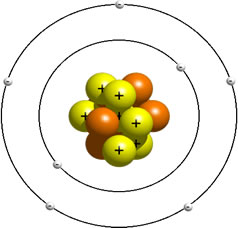
Para esto Bohr se valió de tres postulados:
Primer postulado
El electrón gira alrededor del núcleo en órbitas circulares sin emitir energía radiante.
Segundo postulado
Sólo son posibles aquellas órbitas en las que el electrón tiene un momento angular que es múltiplo entero de h/(2 • p). Puesto que el momento angular se define como L = mvr, tendremos:
mvr = n • h/(2 • p) -> r = a0 • n2 donde:
m: masa del electrón = 9.1 • 10-31 kg
v: velocidad del electrón
r: radio de la órbita que realiza el electrón alrededor del núcleo
h: constante de Planck
n: número cuántico = 1, 2, 3...
a0: constante = 0,529 Å
Así, el Segundo Postulado nos indica que el electrón no puede estar a cualquier distancia del núcleo, sino que sólo hay unas pocas órbitas posibles, las cuales vienen definidas por los valores permitidos para un parámetro que se denomina número cuántico, n.
Tercer Postulado
La energía liberada al caer el electrón desde una órbita a otra de menor energía se emite en forma de fotón, cuya frecuencia viene dada por la ecuación de Planck:
Ea - Eb = h • v
Así, cuando el átomo absorbe (o emite) una radiación, el electrón pasa a una órbita de mayor (o menor) energía, y la diferencia entre ambas órbitas se corresponderá con una línea del espectro de absorción (o de emisión).
Biografía de Niels Bohr
Niels Hendrik
David Bohr. Físico danés. Nació el 7 de octubre de 1.885,Copenhague. Bohr
trabajó,durante 2 años, como becario postgraduado en la Gran Bretaña; conoció a
Ernest Rutherford, cuyo modelo atómico mejoró de forma decisiva con la ayuda de
la teoría cuántica formulada por Max Planck.
Mientras que
Rutherford no consiguió órbitas concretas a los
electrones que giran alrededor del núcleo, Bohr les asignó trayectorias
concretas que dependían de la emisión o captura de quantos de energía.
Tras el descubrimiento de la fisión nuclear por parte de Otto Hahn, Bohr
desarrolló una teoría física para explicar el fenómeno descubierto. A partir
del año 1.926 Bohr fue catedrático de física teórica de la Universidad de
Copenhague. Desde 1.920 dirigió el instituto de física de dicha ciudad. En 1.943 emigró a los Estados Unidos en donde participó en el desarrollo de la bomba atómica estadounidense. Una vez finalizada la Segunda Guerra Mundial regresó a Copenhague.
En 1.922 fue galardonado con el premio Nobel por sus investigaciones acerca de la estructura del átomo. Murió el 18 de noviembre de 1.962, Copenhague.

MODELO CUÁNTICO
El modelo cuántico es el modelo atómico más actualizado y el que se considera más exacto. Es un modelo matemático muy complejo que se basa en la ecuación de Schrodinger. En este modelo se sigue considerando que en el átomo hay un núcleo central formado por protones (+) y neutrones; y alrededor de este núcleo se mueven los electrones (-). Pero los electrones no se mueven en órbitas como postulaba el modelo de Bohr, sino en un esquema más complicado que se resume a continuación:
En un átomo hay niveles que se designan con números: 1, 2, 3, 4, 5, 6, 7.
En cada nivel hay subniveles que se designan con letras: s, p, d, f.
El nivel 1 tiene subnivel s.
El nivel 2 tiene subniveles s, p.
El nivel 3 tiene subniveles s, p, d.
El nivel 4 tiene subniveles s, p, d, f.
El nivel 5 tiene subniveles s, p, d, f.
El nivel 6 tiene subniveles s, p, d.
El nivel 7 tiene subniveles s, p.
En cada subnivel hay orbitales (no es lo mismo que órbitas).
Un subnivel s tiene 1 orbital.
Un subnivel p tiene 3 orbitales.
Un subnivel d tiene 5 orbitales.
Un subnivel f tiene 7 orbitales.
En cada orbital van los electrones. Sólo puede haber un máximo de 2 electrones por cada orbital. Por lo tanto:
Un subnivel s puede tener hasta 2 electrones.
Un subnivel p puede tener hasta 6 electrones.
Un subnivel d puede tener hasta 10 electrones.
Un subnivel f puede tener hasta 14 electrones.
El orden en que los electrones van ocupando los niveles y subniveles en un átomo está dado por el siguiente esquema denominado “Principio de construcción progresiva” o "Regla de las diagonales":


No hay comentarios.:
Publicar un comentario